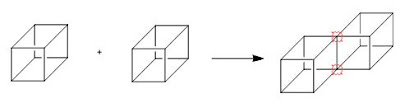
Spesies yang tersusun oleh khusunya unsur-unsur nonlogam seperti H2, O2, N2, H2O, HCl, dan CH4 ternyata mempunyai sifat yang berlawanan dengan sifat-sifat senyawa ionik, sifat tersebut misalnya bukan penghantar listrik. Oleh karena itu, pembentukan ikatan antara atom-atom penyusun molekul menurut model transfer elektron sebagaimana diterapkan untuk molekul ionik tidak lagi tepat. Pernyataan yang menantang para ahli kimia pada awal abad ke dua puluh perihal bagaimana atom-atom itu bergabung membentuk suatu molekul, dijawab oleh Gilbert N. Lewis pada tahun 1916 yang mengusulkan bahwa elektron valensi suatu atom dapat divisualisasikan seolah-olah menempati titik-titik sudut suatu kubus di seputar intinya. Suatu atom yang kekurangan elektron yang diperlukan untuk menempati kedelapan titik sudut kubus dapat mengadakan "persekutuan" melalui rusuk kubus dengan atom lain untuk melengkapi pemilikan oktet seperti pada gambar berikut:
Sebagaimana banyak ide revolusioner umumnya, ide Lewis ini juga ditolak oleh banyak ahli kimia pada waktu itu. Namun demikian konsep pembentukan pasangan-pasangan elektron sekutu kemudian dapat diterima walaupun model diagram kubus tersebut akhirnya hilang tidak mendapat dukungan. Pandangan klasik perihal ikatan kemudian segera berkembang dengan munculnya mekanika kuantum. Linus Pauling pada tahun 1937 mengenalkan model ikatan yang melibatkan tumpang tindih orbital atomik.
Lewis selanjutnya mengidentifikasi ikatan kimia sebagai pasangan elektron sekutu, meskipun tidak dapat menjelaskan mengapa pasangan elektron dan bukan jumlah yang lain harus bertanggungjawab dalam pembentukan ikatan. Pasangan elekron sekutu yang kemudian dikenal sebagai ikatan kovalen, dilukiskan sebagai ikatan tunggal A-B untuk sepasang elektron sekutu, ikatan rangkap dua A=B dan ganda tiga A≡B, masing-masing untuk dua dan tiga pasangan sekutu. Pembentukan pasangan elektron ini untuk mencapai konfigurasi elektron terluar delapan, oktet, seperti halnya dijumpai dalam gas mulia (kecuali He) yang ternyata stabil. Sebagai contoh adalah H2O (air), NH3 (amonia), dan CH4 (metana) sebagai berikut:
Untuk ion, biasanya muatan dilukiskan untuk satu keseluruhan dan bukan untuk atom secara individu, khususnya jika atom-atom pengelilingnya sama. Sebagai contoh adalah ion karbonat sebagai berikut:
Sebagaimana banyak ide revolusioner umumnya, ide Lewis ini juga ditolak oleh banyak ahli kimia pada waktu itu. Namun demikian konsep pembentukan pasangan-pasangan elektron sekutu kemudian dapat diterima walaupun model diagram kubus tersebut akhirnya hilang tidak mendapat dukungan. Pandangan klasik perihal ikatan kemudian segera berkembang dengan munculnya mekanika kuantum. Linus Pauling pada tahun 1937 mengenalkan model ikatan yang melibatkan tumpang tindih orbital atomik.
Lewis selanjutnya mengidentifikasi ikatan kimia sebagai pasangan elektron sekutu, meskipun tidak dapat menjelaskan mengapa pasangan elektron dan bukan jumlah yang lain harus bertanggungjawab dalam pembentukan ikatan. Pasangan elekron sekutu yang kemudian dikenal sebagai ikatan kovalen, dilukiskan sebagai ikatan tunggal A-B untuk sepasang elektron sekutu, ikatan rangkap dua A=B dan ganda tiga A≡B, masing-masing untuk dua dan tiga pasangan sekutu. Pembentukan pasangan elektron ini untuk mencapai konfigurasi elektron terluar delapan, oktet, seperti halnya dijumpai dalam gas mulia (kecuali He) yang ternyata stabil. Sebagai contoh adalah H2O (air), NH3 (amonia), dan CH4 (metana) sebagai berikut:
Untuk ion, biasanya muatan dilukiskan untuk satu keseluruhan dan bukan untuk atom secara individu, khususnya jika atom-atom pengelilingnya sama. Sebagai contoh adalah ion karbonat sebagai berikut:



 Silahkan berbagi artikel tentang
Silahkan berbagi artikel tentang 


